
|
Experiment des Monats
|
Das Zink-Luft-Element ist eine vereinfachte Variante der vielfach noch heute verwendeten "Zink-Kohle-Batterien". In den Batterien dient ebenfalls Zink als Reduktionsmittel, als Oxidationsmittel enthalten sie jedoch Braunstein (MnO2), wobei auch dort die Oxidation an einer Kohleelektrode abläuft. Beide Elemente liefern eine Spannung von etwa 1,5 V.
 |
Geräte und Chemikalien:
Holzkohle (z.B. Lötrohrkohle),
Zinkblech,
6-molare Kalilauge;
Becherglas, Kabel mit Krokodilklemmen, Spannungsmeßgerät.
Durchführung:
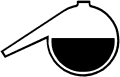
Ein Becherglas etwa 1 cm hoch mit 6-molarer Kalilauge füllen.
Ein Zinkblech und ein dünnes Stück Holzkohle jeweils
mit den Polen eines Voltmeters verbinden und die beiden
Elektroden in die Kalilauge tauchen, ohne daß sie sich
berühren. Am Meßgerät wird eine Spannung von
ca. 1,5 V gemessen. Es kann auch ein kleiner Motor
angeschlossen werden.
Erklärung:
An den beiden Elektroden laufen Redox-Prozesse ab: Zink wird
oxidiert, liefert somit Elektronen, an der Kohleelektrode
wird Sauerstoff aus der Luft reduziert:
Zn 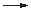 Zn2+ + 2 e–
Zn2+ + 2 e–
O2 + 2 H2O + 4 e–
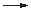 4 OH–
4 OH–
Man erhält somit eine Batterie. Da Zink zu Zn2+-Ionen oxidiert wird, die im alkalischen Milieu Tetrahydroxozinkat-Ionen [Zn(OH)4]2– bilden oder bei höherer Konzentration als Zn(OH)2 ausfallen, löst sich das Zinkblech langsam auf. Die Batterie ist "leer", wenn der in die Kalilauge ragende Teil des Zinkblechs aufgebraucht ist.
Gefahren:

Kalilauge ist ätzend.
Entsorgung:
Die Kalilauge wird mit Salzsäure neutralisiert und dem Abwasser beigegeben.
Literatur & Links:
Ch. H. Hamann, E. Schwarzer, U. Vogel: "Die Zink-Luft-Batterie"
Chemie in unserer Zeit, 6 (1972), 128-131
Nachdruck: "Experimente aus der Chemie", S. 89-94
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Freitag, 31. Mai 2002, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!