
|
Experiment des Monats
|
Wird ein Kupferstab in eine Kupfersalzlösung getaucht, ergibt sich eine Cu2+/Cu-Halbzelle. Deren Potential ist vor allem abhängig von der Konzentration der Kupferionen in der Lösung. Werden zwei Kupfer-Halbzellen mit unterschiedlichen Konzentrationen leitend miteinander verbunden, kann zwischen den Elektroden eine Spannung gemessen werden.
 |
Geräte und Chemikalien:
5 Bechergläser (50 ml), Filterpapier, Spannungsmeßgerät,
2 Kupfer-Elektroden, Kabel und Klemmen;
Kupfer(II)nitrat Trihydrat,
Kaliumnitrat.
Durchführung:
Es werden folgende Elektrolyt-Lösungen benötigt:
(1) 0,1 M KNO3: 5,0 g (0,05 mol) KNO3 in 500 ml Wasser
(2) 0,1 M Cu(NO3)2:
2,4 g (0,01 mol) Cu(NO3)2·3H2O + 3,0 g (0,03 mol) KNO3 in 100 ml Wasser
(3) 0,01 M Cu(NO3)2: durch Verdünnen von 5 ml Lösung (2) mit 45 ml Lösung (1)
(4) 0,001 M Cu(NO3)2: durch Verdünnen von 5 ml Lösung (3) mit 45 ml Lösung (1)
(5) 0,0001 M Cu(NO3)2: durch Verdünnen von 5 ml Lösung (4) mit 45 ml Lösung (1)
Die Lösungen (3)-(5) werden jeweils in ein Becherglas gefüllt, Lösung (2) auf zwei Gläser verteilt.
Zuerst wird die Potentialdifferenz zwischen Lösung (2) und (5) gemessen.
Dazu in beide Bechergläser einen gereinigten Kupferstab als Elektrode stellen.
Als Salzbrücke dient ein mit KNO3-Lösung getränkter Streifen
Filterpapier. Nach etwa 2-3 Minuten ergibt sich am Spannungsmeßgerät ein
konstanter Wert. Zur zweiten Messung wird Lösung (5) durch (4) ersetzt, erneut
die Spannung gemessen und mit (3) und schliesslich der zweiten Probe von Lösung
(2) die Messung wiederholt.
Hinweis: Wichtig ist, daß die Kupferstäbe sauber, oxid- und fettfrei sind.
Bei Bedarf mit 10%iger Salzsäure reinigen und anschließend gründlich spülen.
Erklärung:
Das Potential einer Halbzelle eines Redox-Paares ist insbesondere abhängig
von der Konzentration der gelösten Ionen. Die NERNSTsche
Gleichung ermöglicht die Berechung der Potentiale:
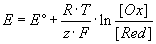
In der allgemeinen Form der NERNSTschen Gleichung wird das Elektrodenpotential E berechnet aus dem Standard-Potential E°, der Zahl der übertragenen Elektronen z, der Faraday-Konstanten F = 96485 C/mol, der allgemeinen Gaskonstante R = 8,314 J/mol·K, der absoluten Temperatur T und den Konzentrationen der oxidierten [Ox] und reduzierten Form [Red].
Für Standardbedingungen (T = 298 K) kann die Gleichung vereinfacht werden:
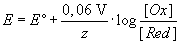
Ist die reduzierte Form ein Metall, wird [Red] = 1 gesetzt.
(Korrekterweise müsste mit den Aktivitäten gerechnet werden, die Aktivität
eines Reinstoffs ist definitionsgemäss a = 1.)
Für eine Kupfer-Halbzelle mit z = 2 gilt somit:
Cu2+ + 2 e–
 Cu
Cu
E = E° + 0,03 V · log [Ox]
Auswertung:
Für eine Kupfer-Halbzelle beträgt das Standard-Potential
(bei 298 K und [Cu2+] = 1 mol/l):
E° = +0,34 V = 340 mV.
Über die NERNSTsche Gleichung können die erwarteten
Werte für die Halbzellen mit geringeren Cu2+-Konzentrationen
berechnet werden:
[Cu2+] = 0,1000 mol/l: E = 310 mV
[Cu2+] = 0,0100 mol/l: E = 280 mV
[Cu2+] = 0,0010 mol/l: E = 250 mV
[Cu2+] = 0,0001 mol/l: E = 220 mV
Da jeweils gegen die 0,1 M Kupfer-Halbzelle mit E = 310 mV
gemessen wird, ergeben sich als Differenz 30, 60 oder 90 mV.
In der abgebildeten Durchführung wurde für die Lösung mit
0,0001 mol/l eine Potentialdifferenz von 83,7 mV gemessen. Aufgrund des
sehr einfachen Versuchsaufbaus ist eine Abweichung < 10% vom Theoriewert
akzeptabel.
Wird für die beteiligten Potentiale jeweils die NERNSTsche Gleichung eingesetzt, ergibt sich:
U = ΔE = E1 – E2
ΔE = 0,03 V · log [Ox]1 – 0,03 V · log [Ox]2
ΔE = 0,03 V · log ([Ox]1/[Ox]2)
Damit kann die Potentialdifferenz direkt aus den beiden Konzentrationen berechnet werden. Aus der Gleichung wird deutlich, daß bei der Konzentrationszelle die Potentialdifferenz unabhängig vom Standardpotential ist.
Gefahren:


Kupfer-Salze sind gesundheitsschädlich, Nitrate brandfördernd.
Entsorgung:
Die Lösungen werden zum Schwermetall-Abfall gegeben.
Literatur & Links:
Praktikum Chemie für Mediziner, Johann Wolfgang Goethe Universität Frankfurt am Main
Chemie für Mediziner: Elektrochemie (Computer-Chemie-Centrum, Erlangen)
Frau Silke Weiß, Institut für Didaktik der Chemie, J.W.Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Freitag, 29. Juni 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!