
|
Experiment des Monats
|
Arterielles und venöses Blut unterscheiden sich in der Farbe: arterielles ist leuchtend rot, venöses erscheint violett-bläulich. Dieser Farbunterschied läßt sich auch in vitro demonstrieren.
 |
Geräte:
Reagenzgläser, Meßpipette (5 ml), Eppendorf-Pipette (20µl) mit Pipettenspitze
Erythrozyten-Suspension (aus abgelaufenen Blutkonserven),
Natriumdithionit.
Durchführung:
In das erste Reagenzglas 5 ml dest. Wasser geben, in das zweite 5 ml 0,02 M
Na2S2O4-Lösung. In beide Gläser 20 µl der
Erythrozyten-Suspension geben und gut schütteln (am besten mit einem Vortex).
5 Minuten warten, nochmals schütteln und die Lösungen vergleichen.
 |
Erklärung:
Im destillierten Wasser (hypotones Medium) platzen die Erythrozyten, wobei das Hämoglobin
freigesetzt wird. Der Sauerstoffgehalt ist ausreichend, so daß praktisch nur Oxy-Hämoglobin
(also mit O2 gesättigtes) vorliegt. Natriumdithionit ist ein starkes Reduktionsmittel.
Vorhandener Sauerstoff wird reduziert, es liegt nur Desoxy-Hämoglobin vor.
Hämoglobin (3D-Modell)
besteht aus vier Untereinheiten. In jeder ist eine Häm-Gruppe gebunden.
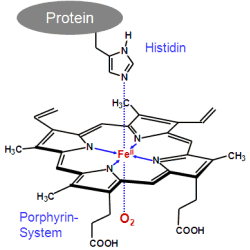
Häm besteht aus einem Porphyrin-System mit einem Eisen(II)-Ion als Zentralion.
Eine axiale Position wird durch einen Imidazol-Ring eines Histidin der Globin-Kette besetzt,
an der zweiten, freien Koordinationsstelle befindet sich im Oxy-Hämoglobin das
Sauerstoff-Molekül im Desoxy-Hämoglobin ein Wassermolekül.
Der Sauerstoff-Ligand erzeugt ein starkes Ligandenfeld, woraus ein low-spin-Komplex resultiert,
im Desoxy-Hämoglobin liegt ein high-spin-Komplex vor. Die beiden Komplexe weisen unterschiedliche
Absorptionsbereiche auf - Oxy-Hb. absorbiert stärker im blauen Lichtspektrum als Desoxy-Hb. und erscheint
daher "roter". Auf der unterschiedlichen Absorption beruht auch die
Pulsoxymetrie
(Messung der Sauerstoffsättigung im Blut).
Gefahren:


Bei der Arbeit mit Blutproben sind aus Sicherheitsgründen Schutzhandschuhe vorgeschrieben.
Natriumdithionit wirkt reizend.
Entsorgung:
Die Lösungen kommen zum Schwermetall-Abfall.
Literatur & Links:
Chemie-Praktikum an der Charité - Universitätsmedizin Berlin
W. Kaim, B. Schwederski: Bioanorganische Chemie (4. Aufl.; Stuttgart: Thieme, 2005)
Lehrbücher der Biochemie
Februar 2010: Struvit-Kristalle
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Sonntag, 28. Februar 2010,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!