Experiment des Monats
Dezember 1998
LANDOLT-Zeitreaktionen

|
Experiment des Monats |


 "Alt-Nassau-Reaktion"
"Alt-Nassau-Reaktion"
Geräte und Chemikalien:
Bechergläser, Magnetrührer oder Rührstäbe,
Meßzylinder.
Ethanol,
Kaliumchlorat,
Kaliumjodat,
Natriumhydrogensulfit,
Natriumsulfit,
Quecksilberchlorid,
konzentrierte Schwefelsäure,
Stärke (Amylose).
Becherglas 1: 100 ml Wasser + 20 ml (C) + 50 ml (B) + 50 ml (A).
Becherglas 2: 200 ml Wasser + 20 ml (C) + 50 ml (B) + 50 ml (A).
Becherglas 3: 300 ml Wasser + 20 ml (C) + 50 ml (B) + 50 ml (A).
Die Lösungen in der angegebenen Reihenfolge zugeben und dabei rühren.
Die farblose Flüssigkeit in Glas (1) schlägt etwa 15 Sekunden nach
Zugabe von Lösung A nach blau um, in Glas (2) nach 30 Sekunden, bei
Glas (3) nach ca. 1 Minute.
Lösung A: 0,3 g KIO3 in 30 ml Wasser.
Lösung B: 5 g KClO3 in 100 ml Wasser.
Lösung C: 0,1 g HgCl2 in 7,5 ml Wasser.
Lösung D: 0,6 g NaHSO3 in 45 ml Wasser.
Lösung E: 10 ml 0,1%ige Stärke-Lösung.
Die Lösungen in der angegebenen Reihenfolge in ein Becherglas
geben und ständig rühren. Die zunächst farblose Flüssigkeit
wird nach einigen Sekunden orangegelb und trüb, nach ca. 1 Minute
schlägt sie nach blau um.
Erklärung:
Bei den Zeitreaktionen laufen mehrere Reaktionen mit unterschiedlicher
Geschwindigkeit ab:
IO3- + 3 SO32-
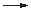 I- + 3 SO42- (langsam)
I- + 3 SO42- (langsam)
5 I- + IO3- + 6 H+
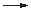 3 I2 + 3 H2O (schnell)
3 I2 + 3 H2O (schnell)
I- + I2 + Stärke
 Jodstärke
Jodstärke
I2 + SO32- + 3 H2O
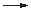 2 I- + SO42- + 2 H3O+ (schnell)
2 I- + SO42- + 2 H3O+ (schnell)
Gefahren:




Die meisten Substanzen sind gesundheitsschädlich, Quecksilberverbindungen
hochgiftig. Kaliumchlorat ist brandfördernd und kann zu Explosionen
führen, wenn es mit brennbaren Stoffen vermischt wird. Schwefelsäure
ist ätzend.
Entsorgung:
Schwermetallabfall.
Literatur:
H. Landolt: "Über die Zeitdauer der Reaktion zwischen Jodsäure
und schwefliger Säure.";
Berichte der Deutschen Chemischen Gesellschaft,
19 (1886), 1317-1365
A. Skrabal: "Die Landoltsche Reaktion";
Zeitschrift für Elektrochemie, 28 (1922), 224-244
H. Römpp, H. Raaf: "Chemische Experimente
mit einfachen Mitteln" - S. 154-156
H. W. Roesky, K. Möckel: "Chemische
Kabinettstücke" - Versuch 102, S. 244-248
G. Wagner: "Chemie in faszinierenden
Experimenten" - Versuch 87, S. 106-108
 zurück zum aktuellen Experiment
zurück zum aktuellen ExperimentSeite erstellt am: Montag, 30. November 1998,
A. Schunk.